研究人员发现,细胞内PKA的动态液-液相分离(liquid-liquid phase separation)可以为小分子cAMP的空间分布及其下游信号转导提供精准的控制;而这种液-液相分离的缺失会使cAMP/PKA通路失调,进而导致细胞过度繁殖,引发癌症。
加州大学圣地亚哥分校药理、生物工程、化学与生物化学系张瑾教授为该文通讯作者,博士生Jason Zhang为该文第一作者。

cAMP是细胞内最重要的第二信使之一,通过将外界刺激整合并传递给下游靶分子如蛋白质激酶A,参与调控包括细胞增殖、分化、凋亡等一系列过程。然而,同一分子是如何区分不同的外界刺激并执行特定功能的呢?
对此,以cAMP的空间区隔化来实其通路特异性的模型已被提出近40年, 然而小分子的空间区隔并不容易。
通常而言,信号分子在信号通路中的忠实性可以通过一些细胞结构来保障。利用膜结构细胞器是一个例子,张瑾指出,“膜结构细胞器就好像一个工厂的不同车间,例如线粒体,不同功能可以在不同车间分开执行”。
对于cAMP,由其它蛋白来调整cAMP产生的位点、生成量等,可以引导不同的下游信号通路 ; 但由于cAMP可以自由扩散, 这些机制被发现仍不足以区隔cAMP, 其完整区隔机制历经近40年研究依然不甚明了。
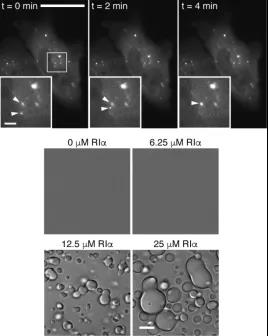
图1:PKA调控亚基R1α在细胞内源表达水平和体外富集后形成液-液相分离。
终于,近日由张瑾教授团队联合加州大学圣地亚哥分校Susan Taylor等团队发现,cAMP以一种令人意外的方式得以区隔化——通过PKA调控亚基R1α的液-液相分离。
PKA是cAMP最重要的靶蛋白,它通过其调控(R)亚基结合cAMP并被激活,从而释放催化亚基执行下游功能。
研究人员利用CRISPR基因编辑技术和该团队擅长的荧光探针技术,敲入绿色荧光蛋白片段至R1α,并使片段在细胞内重组为有活性的荧光探针,从而成功追踪到内源表达水平下的调控亚基R1α可以通过液-液相分离在细胞中形成无膜液滴(Puncta)结构,并以惊人的效率富集细胞内的cAMP。
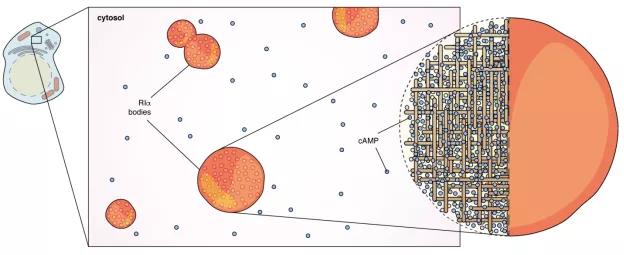
图2:PKA调控亚基R1α通过液-液相分离在细胞中形成无膜液滴并富集高浓度cAMP。
对R1α多区域的突变和对应恢复(rescue)实验表明,R1α中的D/D和linker结构域是其液-液相分离的关键。这种高度浓缩聚集的cAMP形式确保了其在细胞内的位点、生成量可以被精准调控 从而特异性激活PKA。
“占不足1%细胞体积的R1α液滴,可以吸纳99%的细胞内cAMP“,张瑾解释道, “并且这种富集cAMP的液滴一旦被破坏,涌出的大量cAMP会破坏信号通路的特异性,导致细胞不受控的过度增殖,而这正是癌细胞的一大特性”。
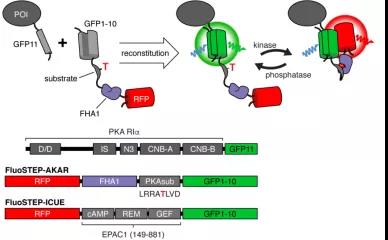
图3:利用FluoSTEP技术,在细胞内组装活性荧光探针并标记内源蛋白,从而研究关键蛋白周围信号通路。
受此发现启发,他们进而发现在纤维板层肝细胞癌(fibrolamellar carcinoma, FLC)中广泛存在的DnaJB1-PKA融合蛋白的确会破坏细胞内R1α的液-液相分离,进而使得cAMP/PKA信号通路失调。
这一发现揭示了FLC可能的发生机理,以及不受控的cAMP导致癌症发生的可能机制。
基于以上研究,作者阐释了非传统、无膜细胞器结构对于小分子第二信使的空间区隔作用,“使得经典的cAMP/PKA通路又翻开了新的篇章”,Susan Taylor指出。